Presentado Por: María Fernanda Devia y Mariana Villanueva Grado:11-1
El pasado 8 de Noviembre del presente año algunos representantes de la UNAD visitaron las instalaciones de la institución educativa Exalumnas de la Presentación con el fin de informarnos a las estudiantes del grado once acerca de la metodología, programas, fechas de admisión, requisitos y beneficios que esta ofrece, asi mismo nos brindaron una charla acerca de la importancia de preservar el medio ambiente y la influencia social actual que ejercemos unos sobre otros.
PROBLEMATICA AMBIENTAL: Calentamiento Global
La presentación dió inicio con la intervención del Ingeniero Ambiental y Sanitario: Carlos Guillermo Mesa, quien nos habló acerca de la mayor problemática ambiental que se vive actualmente como consecuencia de la acción humana, a continuación se presentaran los temas tratados:
- El calentamiento global El término Calentamiento Global se refiere al aumento gradual de las temperaturas de la atmósfera y océanos de la Tierra que se ha detectado en la actualidad, además de su continuo aumento que se proyecta a futuro.
Nadie pone en duda el aumento de la temperatura global, lo que todavía genera controversia es la fuente y razón de este aumento de la temperatura. Aún así, la mayor parte de la comunidad científica asegura que hay más que un 90% de certeza que el aumento se debe al aumento de las concentraciones de gases de efecto invernadero por las actividades humanas que incluyen deforestación y la quema de combustibles fósiles como el petróleo y el carbón. Estas conclusiones son avaladas por las academias de ciencia de la mayoría de los países industrializados.
- El agua, la tierra y el aire constituyen los elementos fundamentales para la vida, sin estos el ser humano no podria sobrevivir y sin embargo, actuamos como si nuestros recursos fuesen ilimitados y la tierra permaneciera intacta para siempre.
Causas del calentamiento Global:
Aguas residuales, Contaminación hídrica, quema de combustibles, contaminación atmosférica, deforestación, desechos sólidos y aumento de la población son las principales causas que provocan que la temperatura de la Tierra aumente cada vez más.
- Los árboles absorben gran parte del CO2 pero los talamos, provocando que estos gases se queden en la atmosferan en grandes cantidades.
- La población cada vez consume más recursos debido al aumento poblacional, agotandolos y provocando un efecto irreversible.
- El transporte genera toneladas de gases de efecto invernadeo.
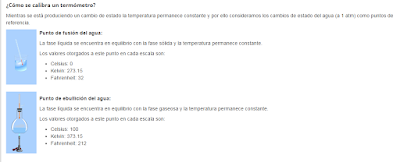
Porcentajes de efecto invernadero: Producción de energía (35%), agricultura y forestación (24%), industria (21%), transporte (14%), construcción (6%).
Consecuencias del Calentamiento Global:

- Deshielo de los Polos: Aumento del nivel del mar, lo cual provocaría una mayor cantidad de agua dulce que terminaria por arrasar ciudades costeras enteras.
- Lluvias severas e inundaciones
- Sequias o inviernos más largos
- Contaminación
Actualmente los países se han puesto un tope máximo de aumento de energía para el 2018 de 2°C, juntos conforman una comisión que pretende detener o disminuir el impacto del cambio climático y salvar al planeta antes de que sea demasiado tarde para todos, pues sin los recursos que nos brinda el planeta la raza humana podria extinguirse. Cabe resaltar que este aumento desmedido de la temperatura se incrementó desde el inicio de la Revolución Industrial.
Es necesario crear un desarrollo sostenible que permita que el hombre pueda crecer y las siguientes generaciones también, existiendo un equilibrio entre recursos y humanos.
Soluciones desde el hogar:
- Comprar lámparas de bajo consumo
- Desconectar el caragdor de los celulares
- Reducir el udo de calefactores o del aire acondicioando
- Mantener las ruedas del auto bien infladas, de esta forma el motor hace menos esfuerzo y se ahorra gasolina
- Utilizar el transporte público
- Viajar en bicicleta
- Caminar
- Utiliza menos el agua caliente cuando tomes un baño
- Separa la basura entre objetos orgánicos e inorgánicos
¡DEBEMOS CAMBIAR NUESTRA MANERA DE PENSAR Y EMPEZAR A ACTUAR AHORA!
INFLUENCIA SOCIAL
El estudiante de psicología de la UNAD: Eisenhoover Garrido nos enseñó este video acerca de la influencia que actualmente ejerce la sociedad sobre nosotros y realizaba una comparación con la problemática ambiental actual: a pesar de que sabemos que contaminar es malo y perjudicial lo seguimos haciendo porque es lo que todos hacen.
INFORMACIÓN ACERCA DE LA UNIVERSIDAD
Beneficios de estudiar en la UNAD:
- Plataforma vistual las 24 horas.
- Mediación tecnológica
- Acompañamiento tutorial
- Acceso a biblioteca virtual
- Herramientas en linea para el aprendizaje: foro, chat, wiki, debate, noticias
- Tutoriales presenciales
- Tiene convenio con el Sena
- Se hace profesional más rápido: solo de 3 a 4 años de carrera (opcional)
Escuelas:
- Agrícola pecuario y medio ambiente
- Ciencias básicas, tecnología e ingeniería
- Administrativas, contables, económicas y de negocios
- Ciencias de la educación
- Ciencias sociales, arte y humanidades
- Ciencias de la salud
Requisitos:
- Ser bachiller
- Haber presentado las Pruebas Saber 11
- Documento de indentidad
- Fotografías
Para mayor información consultar directamente la pagina de la Universidad dando clic aquí.
ACTIVIDAD INTERACTIVA
Para finalizar esta intervención nos dividimos en cuatro grupos con el fin de que cada uno realizara una composición ya sea musical o poética acerca de las acciones que se podrían tener para ayudar al medio ambiente, a continuación se presentan videos de cada una de las creaciones: