LABORATORIO DE GASES
En esta ocasión hablaremos acerca de los gases , en este blog podremos encontrar teoría ejemplos de cada ley que nos puede ayudar a resolver los ejercicios correctamente y comprender un poco mas sus generalidades.
OBJETIVOS
- Tener concepto claros sobre los gases
- Hacer mas fácil el manejo de estos
- Tener claridad sobre que ley usar con cada gas
- Poder realizar cada formula propuesta para el gas
- Conocer las propiedades de los gases
MARCO TEÓRICO
¿Que es un gas?



¿Que es un gas?
Se denomina gas al estado de agregación de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Existen diversas leyes que relacionan la presión, el volumen y la temperatura de un gas.
CONCLUSIONES
A una presión constante el volumen de un gas se expande cuando se calienta y se contrae cuando se expande.
La temperatura y el número de moles para demostrar la ley de Boyle deben ser constantes.
La presión para demostrar la ley de charle debe ser constante.
Si la presión de un gas se duplica el volumen disminuye, y si la presión disminuye el volumen aumenta.
COMPORTAMIENTO DE LOS GASES
Para el comportamiento térmico de partículas de la materia existen cuatro cantidades medibles que son de gran interés: presión, volumen, temperatura y masa de la muestra del material.
Para entender mejor el comportamiento de un gas siempre se realizan estudios con respecto al gas ideal aunque este en realidad nunca existe y las propiedades de este son:
- Un gas está constituido por moléculas de igual tamaño y masa, pero una mezcla de gases diferentes, no.
- Se le supone con un número pequeño de moléculas, así su densidad es baja y su atracción molecular es nula.
- El volumen que ocupa el gas es mínimo, en comparación con el volumen total del recipiente.
- Las moléculas de un gas contenidas en un recipiente, se encuentran en constante movimiento, por lo que chocan, ya entre sí o contra las paredes del recipiente que las contiene.
CONCEPTOS PARA PREPARARSE
- ESTADOS DE AGREGACIÓN:
La materia se presenta en tres estados o formas de agregación: sólido, líquido y gaseoso. Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua. La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
|
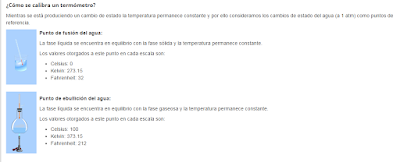
La temperatura indica el grado de movimiento de las partículas de un cuerpo (Energía Cinética de las partículas). La unidad de medida establecida por el Sistema Internacional (SI) es el Kelvin (K). Sin embargo, se utiliza generalmente los grados Celsius (°C). El instrumento que se utiliza para medir la temperatura es el termómetro. Las tres escalas utilizadas son:
Escala Celsius
En esta escala, el grado 0 corresponde al punto donde el agua se solidifica y el grado 100 corresponde al punto de ebullición de la misma.
Escala Absoluta Kelvin
Esta escala fue creada por Lord Kelvin, quien encontró que existe un límite inferior de temperatura por debajo de la cual no pueden enfriarse los cuerpos. Es decir, la temperatura más baja posible. Este valor corresponde a -273,15°C y es denominado cero absoluto (0 K).
Matemáticamente, para expresar en Kelvin una temperatura dada en grados Celsius se emplea la siguiente formula

Escala Fahrenheit
En esta escala, el 0°C, corresponde a 32°F, y 100°C equivalen a 212°F. Para expresar en °C una temperatura entregada en °F se emplea la siguiente formula.

PRESIÓN:
Es la medida del efecto de la distribución de fuerzas normales (perpendiculares) aplicada sobre una superficie o área.

Para una fuerza dada, la presión obtenida sobre un área pequeña será mayo si se ejerce sobre un superficie grande, debido a su distribución.
GAY-LUSSAC
GASES IDEALES:
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal.
Los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Combinando todas las leyes anteriores se llega a la expresión:
P1 V1 / T1 = P2V2 / T2
|
Que es la ecuación general de los gases ideales.
LEY GENERAL:
La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
- P es la presión
- V es el volumen
- T es la temperatura absoluta (en kelvins)
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado
- Ejemplo: un gas tiene una presión de 600 mmHg, un volumen de 670 ml y una temperatura de 100ºC. Calcular su presión a 200ºC en un volumen de 1,5 litros.Solución: Tenemos masa constante de gas por lo que podemos aplicar la Ley General de los Gases: P1 · V1/ T1 = P2 · V2 / T2 , donde:Despejamos P2 :
- P1 = 650 mmHg
- V1 = 670 ml = 0,67 litros
- T1 = 100ºC = 373ºK
- P2 = ?
- V2 = 1,5 litros
- T2 = 200ºC = 473ºK
- P2 = (P1 · V1 / T1 ) · (T2 / V2)
- P2 = (650 · 0,67 / 373) · (473 / 1,5) = 368 mmHg
LABORATORIO
BOYLE
CHARLES
GRAHAM